脳神経病態医学(NCNP)
スタッフ
| 連携准教授 | 間野 達雄 |
|---|
研究概要
神経変性疾患の病態を解明し、効果的な治療戦略を見出すためには、まず患者の脳で実際に生じている変化を正確に捉えることが不可欠です。孤発性疾患では、患者脳を直接観察・解析する帰納的なアプローチが重要となり、遺伝性疾患においても、遺伝子変異の情報に基づいた演繹的アプローチだけでなく、脳組織を直接検証することで初めて正確な病態像を描くことができます。
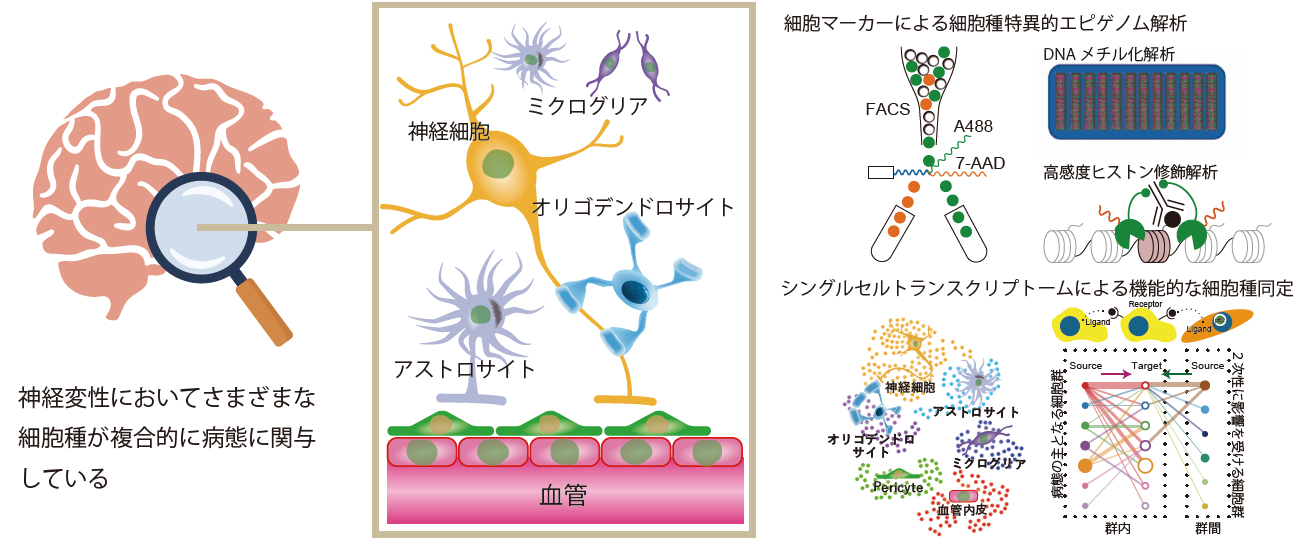
しかし、脳組織は神経細胞やグリア細胞、血管など多様な細胞種から成り立っており、それぞれが有機的に連携して脳全体としての機能を保っています。神経筋疾患の臨床で「どの部位に、どのような症状が現れるか」が重視されるように、病態解析においても「どの細胞種のどのサブタイプに、いかなる生物学的変化が生じているか」を明確に把握することが、疾患メカニズム解明の要となります。
当研究室では、トランスクリプトームやエピゲノムなどの幅広いオミクス解析手法を駆使し、近年目覚ましい発展を遂げているシングルセル解析など先端技術を組み合わせながら、神経変性疾患の複雑な病態を多角的に探究しています。単一細胞解像度の視点から病態の中心となる細胞種を同定し、病態分子の変化のより正確に捉えることで、従来の病理学的枠組みを超えた新たな視点を得ることを目指しています。
一方で、膨大なデータをもとにした“データ駆動アプローチ”には、実際の患者脳由来の多様性や実験系由来の統計的ノイズなど、いくつかの制約や限界も存在します。そこで当研究室では、各疾患の有する臨床的特徴や、病態特異的なタンパク質凝集・異常所見に基づく細胞・動物モデルからの検証を取り入れることで、得られたオミクス情報を的確に解釈し、病態の本質に迫るよう努めています。こうした総合的なアプローチにより、神経変性疾患の理解を深め、新たな治療戦略の糸口となる知見の創出を目指しています。
研究項目
細胞マーカーに基づいた細胞種特異的高感度エピゲノム解析
従来の細胞マーカーを用いたフローサイトメトリーで特定の細胞集団を分離し、近年精度が高まったDNAメチル化・ヒストン修飾・ATACシーケンスなどのエピゲノム解析を行います。これにより、目的の細胞群が持つ特異的なエピジェネティック変化を高感度で検出し、病態メカニズムとの関連を詳細に解明します。結果をシングルセル解析やマルチオミクス解析と組み合わせることで、より包括的な病態理解と新規ターゲットの発見を目指します。
シングルセル解像度による神経変性疾患解析
シングルセル/シングルヌクレウスRNAシーケンスを活用し、個々の細胞レベルでの遺伝子発現パターンを詳細に解析します。従来のバルク解析では見落とされていた希少細胞種やサブタイプの変化を捉え、病変部位や進行度との関連を探究します。こうした高解像度の視点から、新たなバイオマーカーや治療標的の発見を目指します。
病態特異的タンパク質凝集とモデル系を用いた機能解析
神経変性疾患において重要な役割を果たすタンパク質凝集に注目し、細胞モデル・動物モデル基にしたモデル系で毒性メカニズムを検証します。異常タンパク質の構造変化や細胞死への影響を調べ、病態進行を抑制する分子標的を探索します。こうした知見から、新たな治療法や予防戦略の開発を推進します。
(クリックで拡大)
Publication list
- Murai SA, Mano T, Sanes JN, Watanabe T: Atypical intrinsic neural timescale in the left angular gyrus in Alzheimer’s disease. Brain Communications, 6(4):fcae199, 2024
- Kurihara M, Mano T, Eto F, Yao I, Sato K, Ohtomo G, Bannai T, Shibata S, Ishiura H, Ikemura M, Matsubara T, Morishima M, Saito Y, Murayama S, Toda T, Setou M, Iwata A: Proteomic profile of nuclei containing p62-positive inclusions in a patient with neuronal intranuclear inclusion disease. Neurobiology of Disease, 177:105989, 2023
- Mano T, Sato K, Ikeuchi T, Toda T, Iwatsubo T, Iwata A: Peripheral Blood BRCA1 Methylation Positively Correlates with Major Alzheimer’s Disease Risk Factors. The Journal of Prevention of Alzheimer’s Disease, 8(4):477–482, 2021
- Bannai T, Mano T, Chen X, Ohtomo G, Ohtomo R, Tsuchida T, Koshi-Mano K, Hashimoto T, Okazawa H, Iwatsubo T, Tsuji S, Toda T, Iwata A: Chronic cerebral hypoperfusion shifts the equilibrium of amyloid β oligomers to aggregation-prone species with higher molecular weight. Scientific Reports, 9(1):2827, 2019
- Mano T, Nagata K, Nonaka T, Tarutani A, Imamura T, Hashimoto T, Bannai T, Koshi-Mano K, Tsuchida T, Ohtomo R, Takahashi-Fujigasaki J, Yamashita S, Ohyagi Y, Yamasaki R, Tsuji S, Tamaoka A, Ikeuchi T, Saido TC, Iwatsubo T, Ushijima T, et al: Neuron-specific methylome analysis reveals epigenetic regulation and tau-related dysfunction of BRCA1 in Alzheimer’s disease. Proc Natl Acad Sci USA National Acad Sciences., 2017, 114, E9645–9654
連絡先
住所
〒187-8551 東京都小平市小川東町4-1-1
国立精神・神経医療研究センター 神経研究所
tatsuomano@ncnp.go.jp

